ITRACONAZOL-CIMEX 100
Itraconazole.
IDENTIFICATION DU MEDICAMENT
FORMES ET PRÉSENTATIONS
Boite de 4, 15, 30 gélules
COMPOSITION
1 capsule d'Itraconazol-CIMEX contient 100mg d'itraconazolum.
Principe actif : ltraconazolum
Excipients : pro capsula
CLASSE PHAMACOTHERAPEUTIQUE
Itraconazol-CIMEX est un antifongique de synthèse du groupe des triazoles qui exerce son activité sur les dermatophytes, les levures, Aspergillus spp. et différentes autres espèces de champignons pathogènes.
INDICATIONS
• Mycoses systémiques ou viscérales :
- Aspergillomes inopérables symptomatiques.
- Aspergillose bronchopulmonaire et pulmonaire nécrosante, y com¬pris chez l'immunodéprimé.
- Aspergillose invasive de l'immunodéprimé : l'expérience est encore trop limitée pour préciser la place de ('itraconazole par rapport à l'amphotéricine B, en particulier chez le neutropénique (Quelques observations suggèrent son intérêt en relais de l'amphotéricine B sans qu'il soit possible de préciser la durée utile du traitement d'attaque par l'amphotéricine
- Chromomycoses.
- Histoplasmoses.
- Paracoccidioidomycoses.-Sporotrichoses et autres mycoses rares à germes sensibles.
• Mycoses superficielles:
- Kératites fongiques réfractaires aux traitements usuels
- Dermatomycoses superficielles extensives résistantes aux antifongiques usuels
- Onychomycoses: en deuxième intention Candidose orale en deuxième intention Candidoses vulvo-vaginales
POSOLOGIE ET MODE D'ADMINISTRATION
- Posologie usuelle:
• Dermatomycoses ,Tinea corporis, Tinea cruris: 1 capsule 1 x par jour.
Durée du traitement: 2 semaines.
• Tinea pedis, Tinea manus: 1 capsule 1 x par jour.
Durée du traitement: 4 semaines.
• Pityariasis versicolor : 2capsules 2x par jour.
Durée du traitement: 1semaine.
• Candidose oro-pharyngées : 1 capsule 1x par jour.
Durée du traitement: 2 semaines.
• Onychomyoese: traitement intermittent ou traitement continu.
- Traitement intermittent: 2 capsules 2x par jour pendant 1 semaine, suivies par 3 semaines sans traitement.
Pour les infections mycosiques des ongles de la main, il est recommandé de prescrire 2 traitements intermittents et pour les infections mycosiques des ongles des orteils, 3 traitements intermittents.
| Mycose uniquement des ongles de la main |
|
| Semaine 1 |
2 capsules de Itraconazol-CIMEX 2x par jour |
| Semaine 2 |
pas de traitement |
| Semaine 3 |
pas de traitement |
| Semaine 4 |
pas de traitement |
| Semaine 5 |
2 capsules de Itraconazol-CIMEX 2x par jour |
| Semaine 6 |
pas de traitement, fin du traitement |
| Mycose des ongles des orteils avec ou sans atteinte des ongles de la main |
|
| Semaine 1 |
2 capsules de Itraconazol-CIMEX 2x par jour |
| Semaine 2 |
pas de traitement |
| Semaine 3 |
pas de traitement |
| Semaine 4 |
pas de traitement |
| Semaine 5 |
2 capsules de Itraconazol-CIMEX 2x par jour |
| Semaine 6 |
pas de traitement |
| Semaine 7 |
pas de traitement |
| Semaine 8 |
pas de traitement |
| Semaine 9 |
2 capsules de Itraconazol-CIMEX 2x par jour |
| Semaine 10 |
pas de traitement, fin du traitement |
- Traitement continu:
- Mycose des ongles des orteils avec ou sans atteinte des ongles de la main: 2 capsules 1 x par jour.
Durée du traitement: 3 mois.
- Candidose vulvo-vaginale : Le jour de la consultation : 2 capsules à la fin du prochain repas Le jour suiv'ant : 2 capsules après le premier repas de la journée
- Aspergillose: 2 capsules 1 x par jour.
En cas de maladie invasive ou disséminée, augmenter à 2 capsules 2x par jour (matin et soir).
Durée du traitement: 2-5 mois.
- Histoplasmose (extra-méningée): 2 capsules 1x par jour à 2 capsules 2x par jour (matin et soir).
Durée du traitement: 8 mois.
- Sporotrichose (cutanée et lymphatique, non systémique): 1 capsule 1 x par jour.
Durée du traitement: 3 mois.
- Paracoccidioïdomycose: 1 capsule 1 x par jour.
Durée du traitement: 6 mois.
Aucune donnée n'est disponible sur l'efficacité de cette posologie dans la paracoccidioïdomycose chez les patients atteints du SIDA.
- Chromomycose: 1-2 capsules 1x par jour. Durée du traitement: 6 mois.
- Blastomycose: 1 capsule 1x par jour à 2 capsules 2x par jour (matin et soir).
Durée du traitement: 6 mois.
Pour une absorption maximale du principe actif, Itraconazol-CIMEX doit être pris juste après un repas complet.
L'élimination de l'itraconazole à partir de la peau et de l'ongle est plus lente que celle du plasma. C'est pourquoi le résultat clinique et mycologique peut encore s'améliorer après la fin du traitement, jusqu'à 2-4 semaines dans les dermatomycoses et jusqu'à 6-9 mois dans les onychomycoses.
- Emploi pédiatrique
Les données cliniques sur l'emploi d'itraconazole chez l'enfant sont limitées. L'emploi des capsules d'Itraconazol-CIMEX n'est pas recommandé chez l'enfant, sauf si le bénéfice escompté du traitement dépasse les risques possibles (voir «Mises en garde et précautions»).
- Patients avec insuffisance rénale
La biodisponibilité orale chez les patients insuffisants rénaux peut diminuer. Une adaptation de la posologie doit être envisagée (voir «Mises en garde et précautions»).
- Patients avec insuffisance hépatique
L'itraconazole est principalement métabolisé dans le foie. La demi-vie terminale de l'itraconazole est un peu allongée chez le patient cirrhotique. La biodisponibilité orale chez les patients cirrhotiques est légèrement réduite. Une adaptation de la posologie doit être envisagée (voir «Mises en garde et précautions»).
CONTRE-INDICATIONS
Les capsules d'Itraconazol-CIMEX sont contre-indiquées chez les patients présentant une hypersensibilité connue à l'itraconazole ou à l'un des excipients. L'administration concomitante des médicaments suivants avec les capsules d'Itraconazol-CIMEX est contre-indiquée (voir «Interactions»): substrats métabolisés par le CYP3A4 qui peuvent prolonger l'intervalle QT, comme astémizole, bépridil, cisapride, dofétilide, lévacétylméthadol (lévométhadyl), mizolastine, pimozide, quinidine, sertindol et terfénadine. L'administration concomitante peut induire des concentrations plasmatiques plus élevées de ces substances, ce qui peut entraîner un allongement du QT et l'apparition de torsades de pointes; inhibiteurs de la HMG-CoA réductase métabolisés par le CYP3A4 comme simvastatine, lovastatine et atorvastatine; triazolam et midazolam oral; alcaloïdes de l'ergot de seigle comme dihydroergotamine, ergométrine (ergonovine), ergotamine et méthylergométrine (méthylergonovine); nisoldipine.
Itraconazol-CIMEX ne doit pas être utilisé chez les patients montrant des signes de trouble fonctionnel ventriculaire comme l'insuffisance cardiaque décompensée ou chez ceux ayant eu une insuffisance cardiaque décompensée, sauf lorsqu'on doit traiter des infections très graves ou mettant la vie en danger et qu'en même temps on ne peut pas utiliser d'alternatives (voir «Mises en garde et précautions»).
Les capsules d'Itraconazol-CIMEX ne doivent pas être utilisées pendant la grossesse (sauf dans des situations mettant la vie de la patiente en danger - voir «Grossesse/ Allaitement»).
Les femmes en âge de procréer devront se soumettre à une contraception efficace pendant toute la durée du traitement par les capsules d'Itraconazol-CIMEX de même que pendant un cycle menstruel complet suivant l'arrêt du traitement (soit de 5 à 7 semaines).
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI
• Effets cardiaques
Dans des études menées chez des volon¬taires sains, une réduction temporaire sans symptômes de la fraction d'éjection ventriculaire gauche a été observée, se normalisant avant la prochaine perfusion. La pertinence clinique de ce phénomène pour les formules orales est inconnue. On a constaté que l'itraconazole déployait un effet inotrope négatif et que la substance a été associée à des cas d'insuffisance cardiaque. Selon des rapports spontanés, l'insuffisance cardiaque s'est manifestée plus souvent à une posologie de 400 mg d'itraconazole par jour qu'à une posologie plus basse. Ceci laisse supposer que le risque d'insuffisance cardiaque pourrait augmenter avec l'augmentation de la dose journalière d'itraconazole.
Itraconazol-CIMEX ne doit pas être administré à des patients souffrant ou ayant souffert d'insuffisance cardiaque, sauf si les avantages dépassant largement le risque. Afin de peser les avantages et les risques dans chaque cas individuel, il faudra tenir compte de facteurs tels que le degré de la maladie nécessitant l'utilisation d'Itraconazol-CIMEX, la posologie prévue (par ex. dose journalière) et les facteurs de risque indi¬viduels d'une insuffisance cardiaque. Ces facteurs de risque incluent les pathologies cardiaques telles que les maladies coronariennes et valvulaires, les pathologies pulmonaires significatives telles que la maladie pulmonaire obstructive chronique, et les déficiences rénales et autres pathologies pouvant entraîner la formation d'oedèmes. Les patients présentant de tels facteurs de risque doivent être informés des signes et symptômes d'une insuffisance cardiaque et ne seront traités qu'avec prudence. Ils seront surveillés durant le traitement afin de déceler les signes et symptômes d'une insuffisance cardiaque. Si de tels signes ou symptômes devaient apparaître pendant le traitement, l'administration d'Itraconazol-CIMEX sera interrompue. Les antagonistes calciques peuvent avoir un effet inotrope négatif susceptible de renforcer celui de l'itraconazole. De plus l'itraconazole peut gêner le métabolisme des antagonistes calciques. C'est pourquoi la prudence est de mise lors de l'administration simultanée d'itraconazole et d'antagonistes calciques du fait du risque accru d'insuffisance cardiaque. Interactions potentielles.
Itraconazol-CIMEX peut interagir avec d'autres médicaments (voir «Interactions»). L'administration simultanée d'itraconazole et de rifampicine, de rifabutine, de carbamazépine, de phé- nytoïneet de préparations à base de plantes contenant du millepertuis (Hypericum pe rforatum) n'est pas recommandée (voir «Interactions»).
• Diminution de la production d'acide gastrique
Une acidité gastrique insuffisante rend difficile l'absorptign d'itraconazole à partir des capsules d'Itraconazol-CIMEX. Les patients traités par des substances antacides (par ex. hydroxyde d'aluminium) attendront au moins 2 heures après la prise d'Itraconazol-CIMEX pour les prendre. L'administration d'Itraconazol-CIMEX avec une boisson au cola est conseillée aux patients avec achlorhydrie (certains patients atteints du SIDA) ainsi qu'aux patients sous traitement par des substances antisécrétoires gastriques (antagonistes H2, inhibiteurs de la pompe à protons).
• Emploi pédiatrique
Étant donné qu'on ne dispose que de peu de données cliniques relatives à l'emploi d'Itraconazol-CIMEX chez les enfants, son emploi n'est pas recommandé chez ces patients, sauf si le bénéfice escompté du traitement dépasse les risques possibles.
• Effets hépatiques
De très rares cas de toxicité hépatique grave liés à l'utilisation d'itraconazole ont été notifiés, y compris des cas isolés de défaillance hépatique aiguë mortelle. La plupart concernaient des patients porteurs d'une affection hépatique préexistante, traités parce qu'un traitement systémique était indiqué, souffrant d'autres affections graves, et/ou recevant d'autres médicaments hépatotoxiques. Quelques patients n'avaient pas de facteurs de risque manifestes d'affection hépatique. Quelques uns de ces cas ont été observés au cours du premier mois de traitement et quelques autres au cours de la première semaine. Une surveillance de la fonction hépatique doit être envisagée chez les patients recevant Itraconazol-CIMEX. Les patients doivent être informés d'informer immédiatement leur médecin de tous les signes et symptômes qui indiquent une hépatite comme par exemple une perte de l'appétit, des nausées, des vomissements, une fatigue, des douleurs abdominales ou des urines foncées. Chez ces patients, le traitement sera immédiatement interrompu et un bilan des fonctions hépatiques sera réalisé. Itraconazol-CIMEX ne doit pas être administré aux patients qui présentent des valeurs élevées des enzymes hépatiques ou des troubles liés à une affection hépatique active ou aux patients qui ont répondu par le passé par une réaction hépatotoxique à la prise d'autres médicaments, sauf si les avantages escomptés d'un traitement par Itraconazol-CIMEX sont supérieurs aux risques potentiels de lésion hépatique. Dans ces cas, la surveillance des enzymes hépatiques est nécessaire.
• Lésion hépatique
L'itraconazole est principalement métabolisé dans le foie. La demi-vie terminale de l'itraconazole est un peu allongée chez le patient cirrhotique. La biodisponibilité orale est un peu diminuée chez le patient cirrhotique. Une adaptation de la posologie doit être envisagée. Insuffisance rénale La biodisponibilité orale peut être réduite chez les patients souffrant d'insuffisance rénale (voir «Pharmacocinétique, Cinétique pour certains groupes de patients»). Une adaptation de la posologie doit être envisagée.
• Patients immunodéprimés
Chez certains patients immunodéprimés (par ex. patients neutropéniques, sidaïques ou transplantés), la biodisponibilité orale des capsules d'Itraconazol-CIMEX peut être diminuée.
• Patients atteints de mycoses systémiques mettant leur vie en danger immédiat
En raison des propriétés pharmacocinétiques de l'itraconazole, Itraconazol-CIMEX n'est pas recommandé pour débuter un traitement chez les patients atteints de mycoses systémiques représentant un danger imminent pour le pronostic vital.
• Patients atteints du SIDA Chez les patients sidaïques qui ont été traités pour une mycose systémique comme sporotrichose, blastomycose, histoplasmose ou cryptococcose et présentent un risque de récidive, le médecin traitant envisagera la nécessité d'un traitement d'entretien.
• Réactions croisées Aucune information n'est disponible sur les réactions croisées entre l'itraconazole et d'autres antifongiques azolés. En conséquence, Itraconazol-CIMEX sera prescrit avec prudence chez les patients montrant une hypersensibilité à d'autres agents azolés.
• Neuropathie Le traitement sera interrompu si l'apparition d'une neuropathie est imputable à Itraconazol-CIMEX.
• Association avec des corticoïdes à inhaler L'association d'itraconazole et de stéroïdes à inhaler comme par ex. la fluticasone ou le budésonide, peut conduire à une suppression de la corticosurrénale ou à l'apparition d'un syndrome de Cushing, principalement lorsque des stéroïdes oraux comme par ex. la prednisone sont administrés en même temps. Une surveillance clinique des patients s'impose en conséquence et un ajustement posologique des stéroïdes peut s'avérer nécessaire.
CONDUITE ET UTILISATION DE MACHINES
Aucune étude correspondante n'a été effectuée.
INTERACTIONS
• Substances ayant une influence sur l'absorption de l'itraconazole
Les médicaments qui réduisent la production d'acide gênent l'absorption de l'itraconazole à partir des capsules d'Itraconazol-CIMEX (voir «Mises en garde et précautions»). Substances ayant une influence sur le métabolisme de l'itraconazole L'itraconazole est métabolisé principalement par le CYP3A4. Des études d'interactions ont été menées avec la rifampicine, la rifabutine, la carbamazépine et la phénytoïne, qui sont des inducteurs enzymatiques puissants du CYP3A4. Dans ces études, la diminution de la biodisponibilité de l'itraconazole et de l'hydroxy-itraconazole était tellement importante (de 60 à 90%) qu'un échec thérapeutique est possible. En conséquence, l'administration simultanée d'itraconazole et de ces puissants inducteurs enzymatiques est déconseillée. Aucun résultat d'études n'est disponible pour d'autres inducteurs enzymatiques comme le phénobarbital, l'isoniazide et le Hypericum perforatum, mais des effets semblables sont prévisibles. Les inhibiteurs puissants de cette enzyme comme ritonavir, indi- navir, clarithromycine et érythromycine peuvent augmenter la biodisponibilité de l'itraconazole.
• Effet de l'itraconazole sur le métabolisme d'autres substances
L'itraconazole peut inhiber le métabolisme des substances métabolisées par la famille du cytochrome 3A. Cette propriété peut provoquer une augmentation et/ou une prolongation des effets de ces substances, y compris de leurs effets indésirables. Si d'autres médicaments sont administrés en même temps, il faudra consulter le texte de leur information professionnelle pour clarifier leur métabolisation. Après la fin du traitement, les concentrations plasmatiques d'itraconazole baissent progressivement, en fonction de la posologie et de la durée du traitement (voir «Pharmacocinétique»). Cet effet doit être pris en compte dans l'évaluation des effets inhibiteurs de l'itraconazole sur les médicaments administrés de façon concomitante. Font partie de ce groupe de médicaments:
Médicaments contre-indiqués avec l'itraconazole: Xerfénadlne, bepridile, astémizole, mizolastine, cisapride, dofétilide, quinidine, pimozide, lévacétylméthadol (lévométhadyl) et sertindol. L'administration concomitante peut induire des concentrations plasmatiques plus élevées de ces substances, ce qui peut entraîner un allongement du QT et l'apparition de torsades de pointes; inhibiteurs de la HMG-CoA réductase métabolisés par le CYP3A4 comme simvastatine, lovastatine et atorvastatine; triazolam et midazolam oral; alcaloïdes de l'ergot de seigle comme dihydroergotamine, ergométrine (ergonovine), ergotamine et méthylergométrine (méthylergonovine); nisoldipine. La prudence est recommandée en cas d'administration concomitante d'itraconazole et d'antagonistes calciques du fait du risque accru d'insuffisance cardiaque. En plus des interactions pharmacocinétiques possibles dans lesquelles l'enzyme métabolisante CYP3A4 est impliquée, les antagonistes calciques peuvent avoir un effet inotrope négatif pouvant renforcer celui de l'itraconazole. La prudence est également de mise lors de l'administration des médicaments suivants et leurs concentrations plasmatiques, leur efficacité et leurs effets secondaires doivent être surveillés. Lorsqu'ils sont administrés en même temps que l'itraconazole, leur posologie sera réduite si nécessaire: anticoagulants oraux; inhibiteurs de la protéase du VIH comme ritonavir, indinavir ou saquinavir; certains agents antinéoplasiques comme alcaloïdes de la pervenche, busulfan, docétaxel et trimétrexate; antagonistes calciques métabolisés par le CYP3A4, comme par exemple dihydropyridine et vérapamil; certains immunosuppresseurs: ciclosporine, tacrolimus, rapamycine (connue sous la désignation de sirolimus); certains glucocorticoïdes comme budésonide, fluticasone, dexaméthasone et méthylprednisolone; digoxine (par inhibition de la P-glyco- protéine) : autres: alfentanil, alprazolam, brotizolam, busplrone, carbamazépine, cilostazol, disopyramide, ébastine, élétriptan, fentanyl, halofantrine, midazolam i.v., réboxétine, réoaglinide, rifabutine. L'itraconazole n'interagit pas avec la zidovudine (AZT) ou la fluvastatine. Aucun effet inducteur n'a été observé sur le métabolisme des estrogènes et des progestatifs.
• Effet sur la liaison aux protéines plasmatiques In vitro, l'itraconazole n'a pas influencé la liaison aux protéines plasmatiques des substances actives suivantes: imipramine, propranolol, diazépam, cimétidine, indométacine, tolbutamide, sulfaméthazine.
GROSSESSE et ALLAITEMENT
GROSSESSE
Itraconazol-CIMEX ne doit pas être pris pendant la grossesse sauf en cas de menace vitale et de nécessité absolue. Dans les études animales, l'itraconazole s'est avéré tératogène et embryotoxique (voir «Données précliniques»), es informations concernant la prise d'itraconazole pendant la grossesse sont limitées. Des cas d'anomalies congénitales ont été rapportés dans les expériences post-marketing. Ces cas incluaient des malformations du squelette, du tractus uro-génital, cardiovasculaires et ophtalmologiques, ainsi que des anomalies chromosomiques et des malformations multiples. Un lien de cause à effet avec la prise d'itraconazole n'a pas pu être établi.
Femmes en âge de procréer Les femmes en âge de procréer doivent prendre des mesures contraceptives fiables pendant le traitement par traconazol-CIMEX de même que pendant un cycle menstruel complet après l'arrêt du traitement.
ALLAITEMENT
L'itraconazole passe en petites quantités dans le lait maternel. L'allaitement est contre-indiqué pendant un traitement par Itraconazol-CIMEX.
EFFETS INDÉSIRABLES
Les effets indésirables suivants sont apparus fréquemment durant les études: céphalées, troubles fonctionnels respiratoires (rhinite, infections des voies respiratoires supérieures, sinusite), troubles gastro-intestinaux (nausée, diarrhée, douleurs abdominales, dyspepsie, flatulences), troubles fonctionnels hépatiques, éruption cutanée.
Les effets secondaires suivants ont été observés dans le cadre de la surveillance post-marketing:
- Troubles du système sanguin et lymphatique Très rarement : leucopénie, neutropénie, thrombocytopénie
- Troubles du système immunitaire Très rare: maladie sérique, oedème angioneurotique, réactions ana¬phylactiques, anaphylactoïdes et allergiques
- Troubles métaboliques Très rare: hypertriglycéridémie, hypokaliémie
- Troubles du système nerveux central etpériphérique Très rare: neuropathie pé¬riphérique, paresthésie, hypoesthésie, céphalées et vertiges
- Troubles oculaires Très rarement : troubles visuels (y compris vision floue et vision double)
- Troubles de la fonction cardiaque Très rare: insuffisance cardiaque, allant jusqu'à la défaillance cardiaque dans des cas isolés
- Troubles de la fonction respiratoireTrès rare: oedème pulmonaire
- Troubles gastro-intestinauxTrès rare: douleurs abdominales, vomissement, dyspepsie, nausées, diarrhée, constipation et troubles du goût
- Troubles hépatique et biliaire Très rare: toxicité hépatique grave (y compris des cas isolés de défaillance hépatique aiguë mortelle), hépatite, élévation réversible des enzymes hépatiques
- Peau Très rare: nécrolyse épidermique toxique, syndrome de Stevens-Johnson, érythème multiforme, dermatite exfoliative, vasculite induite par un complexe immunitaire, urticaire, alopécie, photosensibilité, éruption cutanée, exanthème, prurit
- Système musculo-squelettique Très rare : myalgie, arthralgie
- Reins et voies urinaires Très rare : mictions fréquentes, incontinence d'urine
- Troubles des organes reproducteurs Très rare: troubles menstruels, troubles de la fonction érectile
- Aufres Très rare: oedèmes
SURDOSAGE
Aucune donnée n'existe à ce jour sur ce sujet. Aucune contre-mesure spécifique n'est connue. Un lavage gastrique peut être pratiqué dans les premières heures suivant l'intoxication. Si nécessaire, administrer du charbon activé. Il n'existe pas d'antidote spécifique. Itraconazol-CIMEX n'est pas dialysable.
PHARMACODYNAMIE
L'effet antifongique d'Itraconazol-CIMEX repose sur l'inhibition sélective de la biosynthèse de l'ergostérol dans la membrane cellulaire du champignon, modifiant ainsi la perméabilité membranaire et entraînant la mort de la cellule fongique.
Activité in vitro de l'itraconazole contre des champignons pathogènes
Sensibilité
- Très sensible: CMI^ <1 µg/rnl ++
- Modérément sensible: CMI90 >1 µg/ml <10 µg/ml +
- Non sensible: CMI90 >10 µg/ml 0 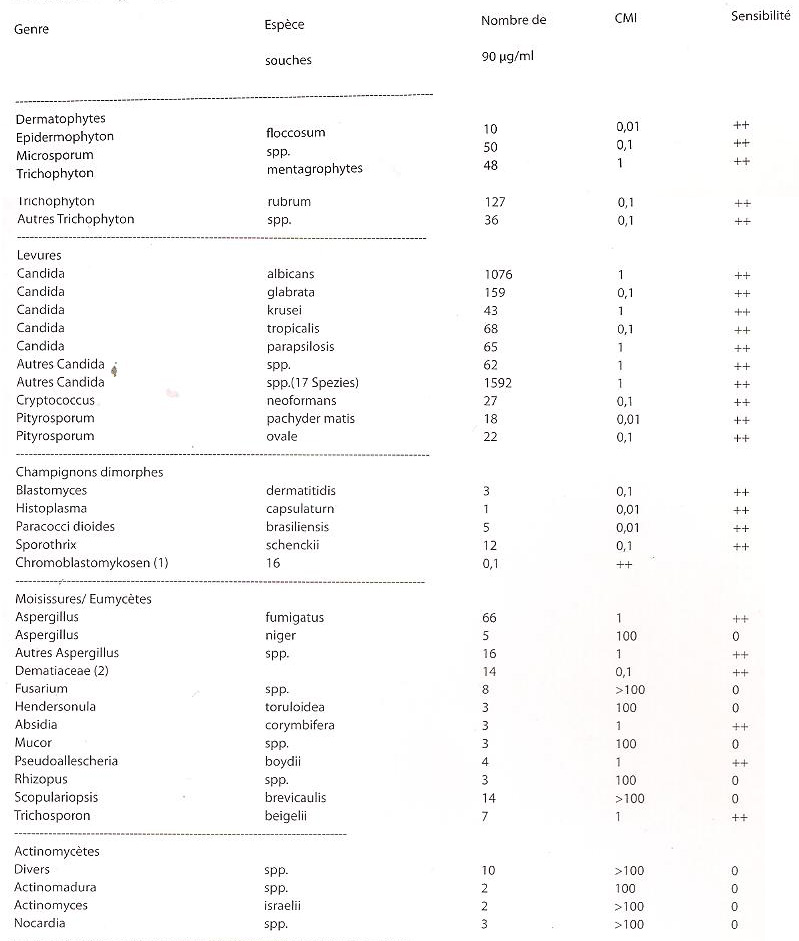
(1 ) Cladosporium carrionii, Fonsecaea spp., Phialophora verrucosa (2) Exophiala jeanselmei, Cladosporium spp., Phaeoannellomyces werneckii, Aureobasidium pullulans, Alternaría alternata, Helminthosporium solani, Curvularia spp., Piedraia hortae, Bipolaris hawaiiensis. L'itraconazole n'agit pas sur les zygomycètes (par ex. Rhizopus spp., Rhizomucor spp., Mucor spp. et Absidia spp.), ni sur Fusarium spp., Scedosprium spp. et Scopulariopsis spp. La CMI a été déterminée par la méthode de dilution. Un substrat nutritif Dixon a été utilisé comme milieu de culture pour Pityrosporum ovale et un bouillon d'infusion coeur/cerveau pour tous les autres champignons. Les cultures ont été incubées à 25°C (champignons) et 37°C (levures) pendant 2 semaines. La concentration minimale inhibitrice (CMI90) correspond à la concentration permettant l'inhibition significative de la croissance de >90% des souches testées.
PHARMACOCINETIQUE
Caractéristiques pharmacocinétiques générales
La pharmacocinétique de l'itraconazole a été étudiée après administration de dose unique et de doses multiples à des volontaires sains, à des personnes de groupes cibles particuliers et à des patients. En général, l'itraconazole est bien résorbé. La concentration maximale est atteinte dans le plasma 2 à 5 heures après la prise orale. L'itraconazole subit une forte métabolisation dans le foie, entraînant la formation de nombreux métabolites. Le métabolite principal est l'hydroxy-itraconazole, dont le taux plasmatique est environ deux fois plus élevé que celui de la substance inchangée. La demi-vie terminale de l'itraconazole est d'environ 17 heures après une dose unique et augmente jusqu'à 34-42 heures en cas de prise répétée.
La pharmacocinétique de l'itraconazole n'est pas linéaire. En conséquence, une accumulation a lieu dans le plasma après une prise multiple. Les concentrations à l'état d'équilibre sont atteintes en 15 jours, avec une Cmax (concentration plasmatique maximale) s'élevant à 0,5 pg/ml après la prise orale de 100 mg 1x par jour, à 1,1 µg/ml après la prise orale de 200 mg 1x par jour et à 2,0 µg/ ml après la prise orale de 200 mg 2x par jour. Après la fin du traitement, le taux plasmatique d'itraconazole baisse en 7 jours à un niveau proche de la limite de détection. La clairance de l'itraconazole diminue avec un dosage plus élevé parce que sa métabolisation dans le foie est limitée par saturation. L'itraconazole est éliminé sous forme de métabolites inactifs dans l'urine (~35%) et les selles (~54%).
• Absorption
L'itraconazole est résorbé rapidement après la prise orale. La concentration maximale plasmatique de la substance inchangée est atteinte 2-5 heures après l'administration d'une dose orale. La biodisponibilité absolue de l'itraconazole est d'environ 55%, la biodisponibilité orale est la plus grande lorsque les capsules sont prises immédiatement après un repas complet. La biodisponibilité absolue diminue de moitié en cas de prise à jeun.
• Distribution
Dans le plasma, la majeure partie de l'itraconazole (99,8%) est liée aux protéines, l'albumine étant le plus important des composants fixateurs (99,6% pour l'hydroxy-métabolite). L'itraconazole a également une affinité marquée pour les lipides. Seulement 0,2% de l'itraconazole se trouve dans le plasma sous forme libre, L'itraconazole est réparti dans l'organisme dans un grand volume virtuel (>7001), ce qui indique une large distribution dans les tissus. La concentration dans les poumons, les reins, le foie, les os, l'estomac, la rate et les muscles est deux à trois fois supérieure à celle observée dans le plasma. Le quotient de concentration cerveau/plasma s'élève à 1 environ. La concentration dans les tissus cornés, en particulier la peau, est jusqu'à quatre fois supérieure à celle observée dans le plasma. L'itraconazole passe en petites quantités dans le lait maternel.
• Métabolisme
L'itraconazole est largement métabolisé par le foie et transformé en un grand nombre de métabolites. Le métabolite principal est l'hydroxy-itraconazole, dont l'activité antifongique in vitro est comparable à celle de l'itraconazole. Le taux plasmatique de l'hydroxy-métabolite est environ deux fois supérieur à celui de l'itraconazole. Des études in vitro ont montré que le CYP3A4 est l'enzyme la plus importante participant au métabolisme de l'itraconazole.
• Elimination
L'itraconazole est éliminé en une semaine sous forme de métabolites inactifs à raison d'environ 35% dans l'urine et à peu près 54% dans les selles. Une dose ingérée sera éliminée sous forme de substance mère inchangée pour moins de 0,03% par les reins et pour 3-18% par les selles.
Une redistribution de l'itraconazole à partir des tissus cornés est manifestement négligeable. En conséquence, son élimination hors de ces tissus se fait dans le cadre de la régénération épidermique.
Contrairement à ce qui passe dans le plasma, la concentration subsiste dans la peau pendant 2 à 4 semaines après l'arrêt d'un traitement de quatre semaines; dans la kératine des ongles de la main et des orteils - ou l'itraconazole peut être décelé déjà 1 semaine après le début du traitement - la concentration subsiste au moins six mois après la fin d'un traitement de trois mois.
La clairance totale est de 381ml/min.
• Cinétique pour certains groupes de patients
Les infections systémiques, la neutropénie et, pour certains patients, une limitation de la fonction rénale peuvent entra entrainer une diminution de la biodisponibilité orale et nécessiter un ajustement posologique.
La biodisponibilité peut être diminuée chez quelques patients souffrant de cirrhose hépatique. Il est recommandé de contrôler la concentration plasmatique d'itraconazole et d'adapter la dose si nécessaire.
DONNÉES PRÉCLINIQUES
Aucun indice ne parle pour un potentiel mutagène de l'itraconazole.
Par l'augmentation des réactions inflammatoire chroniques non néoplasiques au niveau du tissu conjonctif, résultant d'un taux augmenté de cholestérol et de son dépôt dans le tissu conjonctif. Aucun indice ne parle pour une influence primaire sur la fertilité d'un traitement par itraconazole
Chez le rat et la souris, à des doses élevées d'itraconazole, une augmentation dose-dépendante de la toxicité maternelle, de l'embryotoxicité et de la tératogénicité a été observée.
Chez le rat la tératogénicité a consisté en d'importants défauts du squelette et chez la souris en des encéphalocèles et des macroglossiers.
Chez le jeune chien une administration prolongée d'itraconazole . une diminution de la minéralisation des os sur l'ensemble du squelette a été observée. Lors de 3 études de toxicités menées chez le rat, l'itraconazole a induit des défauts osseux avec une réduction d'activité des os plats, une raréfaction de la substance compacte des os longs et une augmentation de leur fragilité
