ULTIVA
Sommaire
Ultiva® 1 mg - Ultiva® 5 mg
Chlorhydrate de rémifentanil.
IDENTIFICATION DU MEDICAMENT
FORMES ET PRÉSENTATIONS
Lyophilisat pour solution injectable (I.V.).
- ULTIVA 1 mg est présenté en flacon (verre) de 3 ml. Boîte de 5 flacons contenant 1 mg de rémifentanil sous forme de poudre lyophilisée.
- ULTIVA 5 mg est présenté en flacon (verre) de 10 ml. Boîte de 5 flacons contenant 5 mg de rémifentanil sous forme de poudre lyophilisée.
COMPOSITION
|
|
Ultiva® 1 mg
|
Ultiva ® 5 mg |
| Chlorhydrate de rémifentanil
|
1,1 mg
|
5,5 mg |
| Quantité correspondant à rémifentanil base
|
1.0 mg
|
5,0 mg |
| Glycine
|
15,0 mg |
|
| Acide chlorhydrique et/ou hydroxyde de sodium
|
q.s.p.pH = 3 |
CLASSE PHAMACOTHERAPEUTIQUE
ANESTHÉSIQUE OPIOIDE. (N : système nerveux central).
INDICATIONS
Le rémifentanil est indiqué comme agent analgésique pendant l'induction et/ou l'entretien de l'anesthésie générale.
POSOLOGIE ET MODE D'ADMINISTRATION
POSOLOGIE
Le rémifentanil doit être administré exclusivement dans un lieu entièrement équipé pour le monitoring et l'assistance des fonctions respiratoire et cardiovasculaire, et par des personnes spécialement formées à l'emploi des médicaments anesthésiques, mais aussi au diagnostic et à la prise en charge des effets indésirables attendus des morphiniques puissants, notamment à la réanimation cardiaque et respiratoire. Cette formation requise inclut la maîtrise de l'établissement et du maintien de la perméabilité des voles aériennes et de la ventilation assistée. Ces recommandations concernent particulièrement l'utilisation en post-opératoire.
Les perfusions continues de rémifentanil doivent être administrées grâce à un système de perfusion à débit contrôlé et par l'intermédiaire d'une tubulure à débit rapide (tubulure de calibre fin) ou d'une tubulure réservée au rémifentanil. Ces tubulures doivent être raccordées directement ou à proximité du cathéter veineux et amorcées pour minimiser l'espace mort potentiel (voir "Mode d'emploi/instructions concernant la manipulation", incluant les tableaux guides pour déterminer les débits de perfusion de rémifentanil en fonction du poids et des besoins anesthésiques des patients).
Des précautions doivent être prises pour éviter que ces tubulures ne soient obstruées ou débranchées et pour éliminer correctement la fraction résiduelle de rémifentanil présente dans la tubulure (Voir "Mises en garde et précautions particulières d'emploi").
Le rémifentanil est exclusivement réservé à l'usage intraveineux et ne doit pas être injecté par voie péridurale ou intrathécale (Voir "Contre-indications").
Le rémifentanil reste stable 24 heures à température ambiante après reconstitution et dilution de la solution, à des concentrations allant de 20 à 250 µg/ml, (la dilution recommandée est de 50 µg/ml chez l'adulte et de 20-25 µg/ml chez les enfants âgés de 1 an ou plus) avec l'une des solutions injectables suivantes :
- eau pour préparations injectables,
- solution de glucose à 5 %,
- solution glucosée (5 %) sodique (0.9%).
- solution de chlorure de sodium à 0,9 %,
- solution de chlorure de sodium à 0,45 %.
50 ug/ml est la dilution recommandée pour l'anesthésie générale. La posologie de rémifentanil doit être individualisée en fonction de la réponce du patient.
Le tableau suivant résume les débits d'injection et de perfusion initiaux et les intervalles posologiques recommandés.
POSOLOGIE DE RÉMIFENTANIL RECOMMANDÉE CHEZ L'ADULTE
| INDICATON
|
INJECTION I.V. (BOLUS) µg/kg
|
PERFUSION CONTINUE (µg/kg/min) |
|
| Débit initial
|
Intervalle posologique
|
||
| Induction de l'anesthésie
|
1
|
0,5 à 1
|
--- |
| Entretien de l'anesthésie chez les patients ventiles - Protoxyde d'azote (66%) - Isoflurane (dose initiale :0,5 CAM) - Propofol (dose initiale : 100 µg/kg/min
|
0,5 à 1
|
0,40
|
0,10 à 2
|
L'administration de rémifentanil par injection en bolus intraveineux lent à l'induction, doit être effectuée en plus de 30 secondes. Aux doses recommandées ci-dessus, le rémifentanil réduit significativement la dose d'hypnotique requise pour entretenir l'anesthésie. Par conséquent, l'isoflurane et le propofol doivent être administrés aux doses préconisées dans le tableau pour éviter une anesthésie trop profonde (Voir "Médicaments associés"). Il n'y a pas de données permettant des recommandations posologiques pour l'utilisation simultanée de rémifentanil avec d'autres hypnotiques.
- Induction de l'anesthésie : Le rémifentanil doit être administré avec un hypnotique tel que le propofol, le thiopental ou l'isoflurane aux doses habituelles pour l'induction de l'anesthésie. Le rémifentanil peut être administré à un débit de perfusion de 0,5 à 1 ug/kg/mn, avec ou sans injection intraveineuse préalable d'un bolus lent de 1 ug/kg administré en plus de 30 secondes. Si l'Intubation trachéale doit être réalisée plus de 8 à 10 minutes après le début de la perfusion de rémifentanil, l'injection d'un bolus n'est pas nécessaire.
- Entretien de l'anesthésie chez les patients ventilés : Après intubation trachéale, le débit de perfusion de rémifentanil doit être réduit, selon la technique anesthésique, comme indiqué dans le tableau précédent. Comme le rémifentanil a un délai d'action court et une durée d'action brève, le débit administré pendant l'anesthésie peut être augmenté par paliers de 25% à 100%, ou réduit par paliers de 25% à 50%, toutes les 2 à 5 minutes, jusqu'à l'obtention du degré désiré d'activité morphinique. En cas d'anesthésle insuffisante, des bolus peuvent être injectés en complément toutes les 2 à 5 minutes.
- Anesthésie en ventilation spontanée : durant les anesthésies en ventilation spontanée, une dépression respiratoire risque de survenir. Une attention particulière est nécessaire pour adapter les doses aux besoins du patient et une assistance ventilatolre peut être requise. Le débit initial de perfusion recommandé pour l'induction et l'entretien de l'anesthésie est de 0,04 ug/kg/mn avec titration jusqu'à obtention de l'effet souhaité. Des débits de perfusion compris entre 0,025 et 0,1 ug/kg/mn ont été étudiés. Les injections en bolus ne sont pas recommandées.
- Recommandations pour l'arrêt ou la poursuite du traitement durant la période post-opératoire immédiate. La durée d'action du rémifentanil étant très courte, l'activité morphinique résiduelle ne persiste pas plus de 5 à 10 minutes après l'arrêt de l'administration. Lors d'interventions chirurgicales réputées douloureuses au réveil, des analgésiques doivent être administrés avant l'arrêt de la perfusion de rémifentanil. Un délai suffisant doit être respecté pour que les analgésiques de longue durée d'action atteignent leur effet maximum. Ces analgésiques doivent être choisis en fonction de type d'Intervention chirurgicale et du niveau de surveillance post-opératoire. Dans le cas où le traitement par les analgésiques de longue durée d'action n'a pas été instauré avant la fin de l'intervention chirurgicale, l'administration de rémifentanil doit être poursuivie pour maintenir l'analgésie durant la période post-opératoire immédiate, jusqu'à ce que les analgésiques de longue durée d'action atteignent leur effet maximum.
Chez les patients ventilés,le débit de perfusion doit continuer à être adapté en fonction de l'effet souhaité.
Chez les patients en ventilation spontanée,le débit de perfusion de rémifentanil doit être initialement réduit à un débit de 0,1 ug/kg/mn. Le débit de perfusion peut être ensuite augmenté ou diminué par paliers maximum de 0,025 ug/kg/mn toutes les cinq minutes en fonction du niveau d'analgésie et de la fréquence respiratoire du patient. Le rémifentanil doit toujours être administré dans un Heu entièrement équipé pour le monitoring et l'assistance des fonctions respiratoire et cardiovasculaire, sous la surveillance étroite de personnes spécialement formées au diagnostic et à la prise en charge des effets respiratoires des morphiniques puissants.
L'utilisation de bolus intraveineux de rémifentanil pour traiter la douleur pendant la période post-opératoire n'est pas recommandée chez les patients en ventilation spontanée.
- Médicaments associés : Le rémifentanil réduit les quantités ou les doses d'anesthésiques inhalés, d'hypnotiques et de benzodiazépines requises pour l'anesthésie (Voir "Interactions avec d'autres médicaments et autres formes d'interactions"). En cours d'anesthésie, l'administration concomitante de rémifentanil a permis de réduire les doses d'isoflurane, de thiopental, de propofol ou de témazépam dans des proportions allant jusqu'à 75%.
- Enfants (de 1 à 12 ans) : Les données disponibles sont insuffisantes pour recommander une posologie dans cette classe d'âge (Voir "Propriétés pharmacocinétiques").
Patients âgés (de plus de 65 ans) : Chez les patients âgés de plus de 65 ans, les posologies Initiales recommandées pour l'adulte doivent être diminuées de moitié, puis adaptées aux besoins de chaque patient, étant donné la sensibilité accrue des sujets âgés aux effets pharmacologiques du rémifentanil. Cet ajustement des doses s'applique pour toutes les phases de l'anesthésie : induction, entretien de l'anesthésie générale et sédation de la douleur post-opératoire immédiate.
- Patients de classes ASA lll/IV : comme les effets hémodynamiques des opioîdes puissants risquent d'être plus Importants chez les patients de classes ASA lll/IV, l'administration de rémifentanil doit être réalisée avec précaution dans cette population. Il est donc recommandé de réduire la dose initiale et d'adapter ultérieurement le débit jusqu'à obtention de l'effet souhaité. Les données disponibles en pédiatrie sont insuffisantes pour permettre des recommandations posologlques.
- Patients obèses : En cas d'obésité, la posologie de rémlfentanil doit être réduite et basée sur le poids Idéal théorique du patient car la clairance et le volume de distribution du rémlfentanil sont mieux corrélés au poids idéal théorique qu'au poids réel.
- Insuffisance rénale : Sur la base des données disponibles à ce jour, une adaptation posologlque chez les patients ayant une altération de la fonction rénale n'apparaît pas nécessaire.
- Insuffisance hépatique : Les résultats observés au cours des études menées sur un nombre limité de patients présentant une altération des fonctions hépatiques, ne justifient pas d'adaptation posologique dans cette population. Toutefois, les patients atteints d'une insuffisance hépatique sévère peuvent être légèrement plus sensibles aux effets dépresseurs respiratoires du rémifentanil (Voir "Mises en garde et précautions particulières d'emploi). Ces patients nécessitent donc une surveillance étroite et la posologie de rémifentanil doit être adaptée aux besoins individuels de chaque patient.
- Chirurgie cardiaque : Il n'est pas nécessaire de réduire la dose initiale (cf. rubrique Anesthésie en chirurgie cardiaque - tableau).
- Neurochirurgie : L'expérience clinique limitée en neurochirurgie a montré que des recommandations posologiques particulières n'étaient pas nécessaires.
- Utilisation à long terme en Unité de Soins Intensifs : Il n'existe pas de données sur l'utilisation au long cours (plus de 24 heures) du rémifentanil chez les patients traités en Unité de Soins Intensifs.
MODE D'ADMINISTRATION
• ULTIVA doit être reconstitué par addition de 1 ml ou 5 ml de solution injectable pour obtenir une solution reconstituée ayant environ une concentration en rémifentanil de 1 mg/ml. Après reconstitution, la solution d'ULTIVA ne doit pas être administrée en l'état mais doit encore être diluée à des concentrations allant de 20 à 250 µg/ml avec l'une des solutions injectables suivantes :
- eau pour préparations injectables,
- solution de glucose à 5 %,
- solution glucosée (5%) sodique (0,9%),
- solution de chlorure de sodium à 0,9%,
- solution de chlorure de sodium à 0,45%.
La dilution sera fonction des caractéristiques techniques du matériel de perfusion et des besoins estimés pour le patient.
• ULTIVA s'est révélé compatible avec les solutions pour injection intraveineuse suivantes lorsqu'il est injecté dans une tubulure en cours de perfusion :
- soluté injectable de Ringer lactate,
- soluté injectable de Ringer lactate glucose à 5%.
• ULTIVA s'est révélé compatible avec le propofol lorsqu'il est injecté dans une tubulure en cours de perfusion.
LES TABLEAUX SUIVANTS SONT DES GUIDES POUR DÉTERMINER LES DÉBITS DE PERFUSION D'ULTIVA 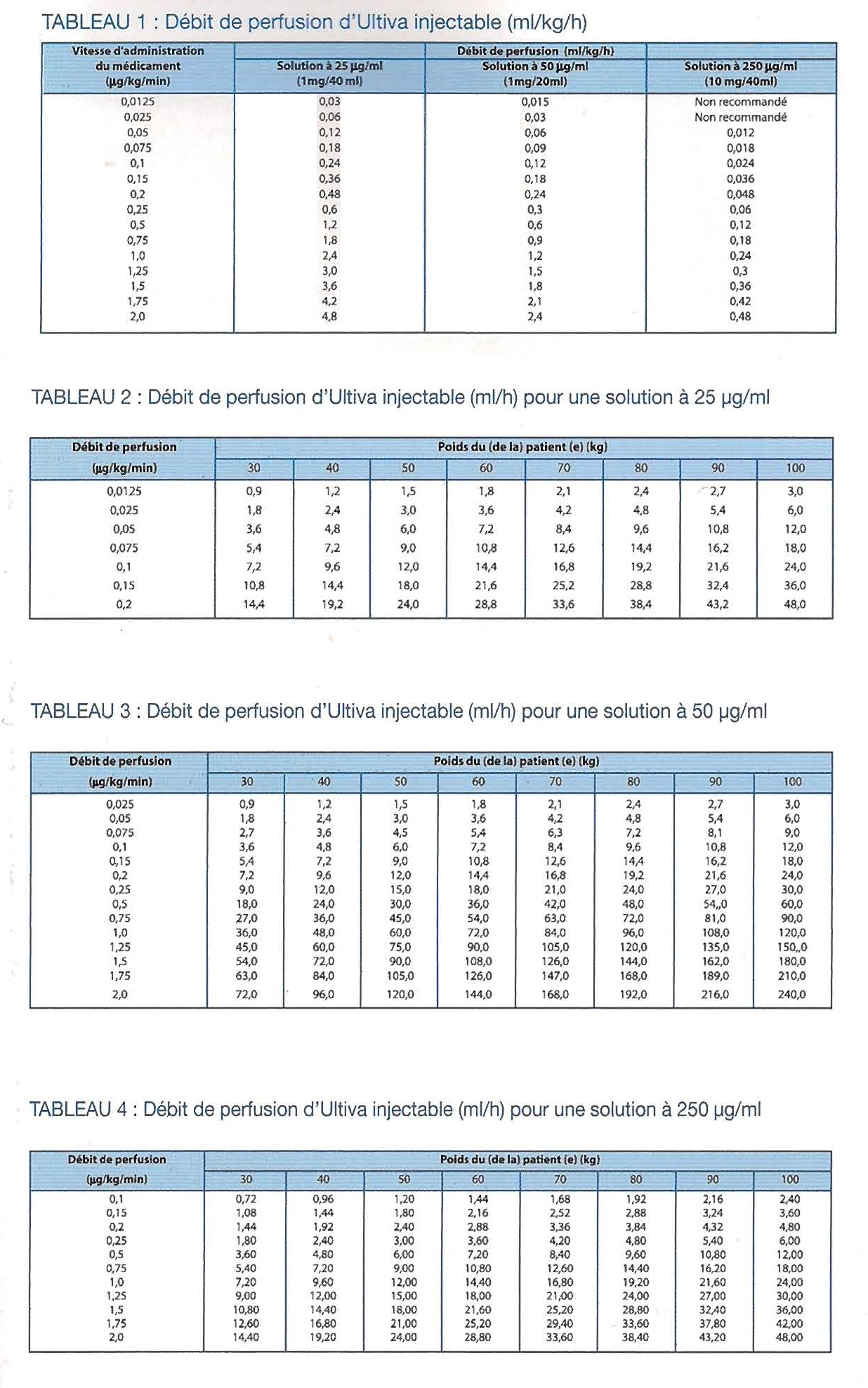
CONTRE-INDICATIONS
- ULTIVA contenant de la glycine, son administration par voie péridurale ou intrathécale est contre-indiquée (Voir "Données de sécurité précliniques").
- ULTIVA est contre-indiqué en cas d'hypersensibilité connue à l'un des constituants de la préparation ou à d'autres dérivés du fentanyl.
- L'utilisation de rémifentanil en monothérapie durant l'induction de l'anesthésie est contre-indiquée.
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI
Le rémifentanil doit être administré exclusivement dans un lieu entièrement équipé pour le monitoring et l'assistance des fonctions respiratoire et cardio-vasculaire, et par des personnes spécialement formées à l'utilisation des médicaments anesthésiques, mais aussi au diagnostic et à la prise en charge des effets Indésirables attendus des morphiniques puissants, notamment à la réanimation cardiaque et respiratoire. La formation requise inclut l'établissement et le maintien de la perméabilité des voies aériennes et la ventilation assistée.
• Rigidité musculaire : prévention et prise en charge : Aux doses recommandées, une rigidité musculaire peut survenir. Comme avec les autres morphiniques, l'incidence de la rigidité musculaire dépend de la dose et de la vitesse d'administration. C'est pourquoi les injections intraveineuses de rémifentanil sous forme de bolus lent ne doivent pas être effectuées en moins de 30 secondes. La prise en charge de la rigidité musculaire induite par le rémifentanil doit être adaptée à l'état clinique du patient et repose sur l'assistance des fonctions vitales. L'apparition d'une rigidité musculaire excessive pendant l'induction de l'anesthésie doit être traitée par l'administration d'un curare et/ ou l'adjonction d'agents hypnotiques. Les rigidités musculaires observées pendant l'administration de rémifentanil comme analgésique peuvent être traitées par l'arrêt ou la diminution du débit de la perfusion de rémifentanil. La rigidité musculaire disparaît quelques minutes après l'arrêt de la perfusion de rémifentanil. Il est également possible d'administrer un antagoniste morphinique mais l'effet analgésique du rémifentanil risque alors d'être atténué ou supprimé.
• Dépression respiratoire : prévention et prise en charge : Comme avec tous les morphiniques puissants, l'analgésie intense s'accompagne d'une dépression respiratoire marquée. Par conséquent, le rémifentanil ne peut être administré que dans des lieux équipés des moyens nécessaires pour déceler et prendre en charge une dépression respiratoire. Des précautions particulières doivent être prises pour les patients ayant une insuffisance respiratoire. La survenue d'une dépression respiratoire impose une prise en charge adéquate, incluant une diminution de 50% du débit de perfusion ou une interruption temporaire de la perfusion. À la différence des autres dérivés du fentanyl, le rémifentanil n'a jamais provoqué de dépression respiratoire récurrente, même après une administration prolongée. Cependant, comme de nombreux facteurs peuvent affecter le réveil, il est important de veiller à ce que le patient ait complètement repris conscience et récupéré une ventilation spontanée adaptée avant de le laisser quitter la salle de réveil.
• Effets cardiovasculaires : Selon les cas, l'hypotension artérielle et la bradycardie seront prises en charge en réduisant le débit de perfusion de rémifentanil ou la dose des anesthésiques administrés parallèlement, ou bien par un remplissage vasculaire ou encore par l'administration de vasopresseurs ou d'anticholinergiques. Les patients en mauvais état général, hypovolémiques ou hypotendus et les personnes âgées peuvent être plus sensibles aux effets cardiovasculaires du rémifentanil.
• Action de courte durée : Compte-tenu de la disparition très rapide de l'effet analgésique du rémifentanil, l'activité résiduelle ne persiste pas plus de 5 à 10 minutes après l'arrêt de l'administration. Lors d'interventions chirurgicales réputées douloureuses au réveil, des analgésiques doivent être administrés avant l'arrêt de la perfusion de rémifentanil. Un délai suffisant doit être respecté pour que les analgésiques de longue durée d'action atteignent leur effet maximum. Ces analgésiques doivent être choisis en fonction du type d'intervention chirurgicale et du niveau de surveillance post-opératoire. La dose et le moment de leur administration doivent être planifiés à l'avance et de façons adaptée à chaque patient. Lors de l'administration d'agents morphiniques en relais analgésique, le bénéfice d'une prise en charge optimale de la douleur doit toujours être évalué en fonction du risque potentiel de dépression respiratoire de ces agents.
• Administration accidentelle : Du rémifentanil peut être présent en quantité suffisante dans l'espace mort de la tubulure ou du cathéter pour provoquer une dépression respiratoire, une apnée et/ou une rigidité musculaire si la tubulure est rincée avec une solution injectable ou avec d'autres médicaments injectables. Cela peut être évité en administrant le rémifentanil dans une tubulure à débit rapide ou dans une tubulure réservé au rémifentanil, qui sera débranchée à l'arrêt de l'administration.
• Enfants : Il n'existe aucune donnée concernât l'utilisation du rémifentanil chez les nouveau-nés et les nourrissons âgés de moins de 1 an.
• Pharmacodépendance : Comme les autres morphiniques, le rémifentanil peut induire une dépendance.
CONDUITE ET UTILISATION DE MACHINES
Après une anesthésie comportant du rémifentanil, le patient ne doit ni conduire, ni utiliser des machines. Seul le médecin peut décider du moment de reprise de ces activités. Il est prudent que le patient soit accompagné lors de son retour à domicile et qu'il ne consomme pas de boisson alcoolisée.
INTERACTIONS
Le rémifentanil n'étant pas métabolisé par les pseudocholinestérases plasmatiques, des interactions avec les médicaments métabolisés par ces enzymes ne sont pas attendues. Comme les autres morphiniques, le rémifentanil réduit les doses d'anesthésiques inhalés ou intraveineux et de benzodiazépines requis pour l'anesthésie (voir "Posologie et mode d'administration"). En cas de non diminution des doses de médicaments dépresseurs du système nerveux central associés, les patients peuvent être exposés à une augmentation de l'incidence des effets indésirables liés à ces produits.
Incompatibilité
ULTIVA doit être reconstitué ou mélangé uniquement avec les solutions injectables recommandées (voir "Mode d'emploi, instructions concernant la manipulation").
Il ne doit pas être reconstitué ou mélangé avec du soluté injectable de Ringer lactate ou du soluté Injectable de Ringer lactate glucose à 5 %.
ULTIVA ne doit pas être mélangé avec le propofol ni placé dans la même solution pour perfusion. Il n'est pas recommandé de perfuser ULTIVA par la même tubulure que le sang, le sérum ou le plasma, car les estérases non spécifiques contenues dans les produits sanguins risquent d'hydrolyser le rémifentanil en son métabolite inactif. ULTIVA ne doit pas être mélangé avec d'autres spécialités pharmaceutiques avant son administration.
GROSSESSE et ALLAITEMENT
Aucune étude spécifique et contrôlée n'a été conduite chez des femmes enceintes. Le rémifentanil ne doit donc être administré pendant la grossesse que si les bénéfices attendus justifient les risques potentiels pour le foetus. Le passage du rémifentanil dans le lait maternel n'est pas connu.
Cependant, les dérivés du fentanyl sont excrétés dans le lait maternel chez la femme et des dérivés du rémifentanil ont été détectés dans le lait de rates après administration de rémifentanil. En conséquence, les femmes qui allaitent doivent être informées de ne pas donner le sein pendant les 24 heures suivant l'administration du rémifentanil. Travail et accouchement : La sécurité d'emploi du rémifentanil pendant le travail et l'accouchement n'a pas été établie. Le rémifentanil ne doit pas être administré pendant le travail et durant les césariennes car le rémifentanil passe la barrière placentaire et les dérivés du fentanyl peuvent provoquer des dépressions respiratoires chez l'enfant.
EFFETS INDÉSIRABLES
Les effets indésirables les plus fréquemment observés avec le rémifentanil découlent directement de la pharmacologie des agonistes morphiniques µ. L'incidence globale des effets indésirables observés au cours de l'ensemble des essais contrôlés, aux posologies recommandées, est la suivante :
- Très fréquents (> 10 %) : nausées, vomissements, hypotension, rigidité musculaire. Fréquents (1 à 10 %) : frissons, bradycardie, dépression respiratoire aiguë, apnée, hypertension post-opératoire.
- Peu fréquents (0,1 à 0,9 %) : hypoxie, constipation, douleur post-opératoire.
- Rares (< 0,1 %) : sédation (durant la phase de réveil).
- Très rarement, des réactions allergiques incluant des réactions anaphylactiques ont été rapportées chez des patients recevant ULTIVA en association avec un ou plusieurs agents anesthésiques.
SURDOSAGE
Comme avec tous les analgésiques morphiniques puissant, un surdosage devrait se traduire par une accentuation des effets pharmacologiques prévisibles du rémifentanil.
Compte tenu de la très courte durée d'action du rémifentanil, le risque d'effets délétères dus au surdosage est limité aux quelques minutes suivant l'administration du médicament. Après arrêt du traitement, le retour du patient à l'état initial se fait en moins de 10 minutes. Dans l'éventualité d'un surdosage avéré ou suspecté, la conduite à tenir est la suivante : arrêter l'administration du rémifentanil, assurer la perméabilité des voies aériennes, entreprendre une ventilation assistée ou contrôlée avec une oxygénation et maintenir une fonction cardiovasculaire adaptée. Si la dépression respiratoire est associée à une rigidité musculaire, l'administration d'un curare peut être nécessaire pour faciliter la ventilation assistée ou contrôlée. Le remplissage vasculaire, l'administration de vasopresseurs pour corriger l'hypotension artérielle et d'autres mesures d'assistance des fonctions vitales peuvent être utiles. En cas de dépression respiratoire sévère et de rigidité musculaire, un antagoniste morphinique, comme la naloxone, peut être administré par voie intraveineuse à titre d'antidote spécifique. La durée de la dépression respiratoire secondaire à un surdosage en rémifentanil a un peu de chances d'excéder la durée d'action de l'antagoniste morphinique.
PHARMACODYNAMIE
Le rémifentanil est un agoniste sélectif des récepteurs morphiniques µ, avec un court délai d'action et une durée d'action très brève. L'activité morphinique du rémifentanil est antagonisée par les antagonistes des morphiniques, comme la naloxone. Les dosages d'hlstamine effectués chez des patients et des volontaires sains ayant reçu jusqu'à 30 µg/kg de rémifentanil par injection intraveineuse en bolus n'ont pas révélé d'élévation des taux d'histamine.
PHARMACOCINETIQUE
Après l'administration du rémifentanil aux doses recommandées, la demi-vie d'élimination effective varie de 3 à 10 minutes. Chez les adultes jeunes sains, la clairance moyenne du rémifentanil est de 40 ml/ mn/kg, le volume de distribution central de 100 ml/kg et le volume de distribution à l'état d'équilibre de 350 ml/kg. Aux doses recommandées, les concentrations sanguines du rémifentanil sont proportionnelles à la dose administrée. Pour chaque augmentation du débit de perfusion de 0,1 µg/kg/mn, la concentration sanguine de rémifentanil s'accroît de 2,5 ng/ml. Le taux de liaison du rémifentanil aux protéines plasmatiques est voisin de 70 %.
• Métabolisme :
Le rémifentanil est un dérivé morphinique, métabolisé par les estérases, notamment par des estérases non spécifiques du sang et des tissus. Le métabolisme du rémifentanil aboutit à la formation d'un métabolite, l'acide carboxylique, qui chez le chien est 4 600 fois moins actif que le rémifentanil. Les études chez l'homme montrent que l'ensemble de l'activité pharmacologique est lié à la molécule mère. L'activité de ce métabolite n'a donc pas de conséquences cliniques. Chez les adultes sains, la demi-vie du métabolite est de 2 heures. Chez les patients ayant une fonction rénale normale, 95 % du métabolite principal du rémifentanil sont éliminés dans les urines, en 7 à 10 heures environ. Le rémifentanil n'est pas un substrat pour les cholinestérases plasmatiques (dont les pseudocholinestérases).
• Passage transplacentaire et passage dans le lait maternel : Les études menées sur le passage transplacentaire chez le rat et le lapin ont montré que les foetus étaient exposés au rémifentanil et/ou à ses métabolites pendant leur croissance et leur développement. Chez le rat, les métabolites du rémifentanil passent dans le lait. Dans un essai clinique chez l'homme, la concentration de rémifentanil dans le sang foetal était approximativement de 50 % de la concentration sanguine maternelle. Le rapport entre les concentrations artérielle et veineuse du rémifentanil est approximativement de 30 % chez le foetus, ce qui suggère l'existence d'un métabolisme du rémifentanil chez le nouveau-né.
•Insuffisance rénale : La pharmacocinétique du rémifentanil est inchangée chez les patients atteints d'une Insuffisance rénale sévère (clairance de la créatinine < 10 ml/mn). Chez les patients anéphriques, la demi-vie du métabolite, l'acide carboxylique, est plus longue et atteint environ 30 heures. Toutefois, connaissant l'activité estimée de ce métabolite par rapport à celle de la molécule mère (4.600 fois plus faible), les simulations pharmacocinétiques Indiquent que le métabolite, l'acide carboxylique, n'atteindra pas des concentrations cliniquement actives lors de perfusions de rémifentanil à des débits allant jusqu'à 2 µg/kg/mn poursuivies jusqu'à 12 heures.
• Insuffisance hépatique : La pharmacocinétique du rémifentanil est inchangée chez les patients présentant une insuffisance hépatique sévère en attente d'une transplantation hépatique, ou pendant la phase anhépatique de la transplantation hépatique. Les patients atteints d'une insuffisance hépatique sévère peuvent être un peu plus sensibles aux effets dépresseurs respiratoires du rémifentanil. Ces patients nécessitent donc une surveillance étroite et la posologie du rémifentanil doit être adaptée à leurs besoins Individuels.
• Enfants : La pharmacocinétique du métabolite acide carboxylique chez les enfants de 2-17 ans est comparable à celle des adultes après ajustement en fonction du poids corporel.
• Patients âgés : La clairance du rémifentanil est légèrement réduite chez les patients âgés (de plus de 65 ans) par rapport à celle observée chez les jeunes patients. L'activité pharmacodynamique du rémifentanil augmente avec l'âge. Par comparaison aux sujets plus jeunes, la concentration efficace 50 (CE50) nécessaire chez les patients âgés pour la formation d'ondes delta sur l'électro-encéphalogramme (EEG) est réduite de 50 % ; par conséquent, les posologies Initiales recommandées de rémifentanil doivent être réduites de moitié chez les personnes âgées, puis adaptées avec soin aux besoins de chaque individu.
DONNÉES DE SÉCURITÉ PRÉCLINIQUES
- Toxicité aiguë : Les manifestations attendues d'intoxication par agonisme morphinique u ont été observées chez la souris, le rat et le chien non ventilés, après l'administration d'une forte dose de rémifentanil Injectée en bolus intraveineux. 'Dans ces études, l'espèce la plus sensible, le rat mâle, a survécu à l'administration d'une dose de 5 mg/kg. Des micro-hémorragies cérébrales provoquées par l'hypoxie, observées chez les chiens, ont été réversibles dans les 14 jours suivant l'arrêt de l'administration de rémifentanil.
- Toxicité à doses répétées : Des doses de rémifentanil administrées en bolus chez le rat et le chien non ventilés, ont entraîné une dépression respiratoire pour l'ensemble des doses étudiées et des micro-hémorragies cérébrales réversibles chez le chien. Des investigations complémentaires ont montré que les micro-¬hémorragies résultaient de l'hypoxie et n'étaient pas spécifiques au rémifentanil. Les micro-hémorragies cérébrales n'ont pas été observées dans les études de perfusion chez le rat et le chien non ventilés car celles-ci ont été réalisées à des doses qui ne provoquaient pas de dépression respiratoire sévère. Les résultats des études précliniques font apparaître la dépression respiratoire et les séquelles associées comme étant la cause la plus probable des effets indésirables potentiellement sévères chez l'homme. L'administration intrathécale de l'excipient seul (glycine), chez le chien, provoque une agitation, une douleur, une incoordination et un dysfonctionnement des membres postérieurs. Ces effets sont considérés comme étant liés à la glycine. En raison du pouvoir tampon du sang plus important, de la dilution plus rapide dans la circulation sanguine et de la faible concentration en glycine dans la formulation d'ULTIVA, l'administration intraveineuse du produit est sans conséquence clinique.
- Étude sur la fonction de reproduction : Le rémifentanil provoque une diminution de la fertilité chez le rat mâle, après une injection intraveineuse quotidienne, pendant au moins 70 jours. Une dose sans effet sur la fertilité n'a pas été mise en évidence. La fertilité chez le rat femelle n'est pas modifiée. Aucun effet tératogène n'a été observé chez le rat ou le lapin. L'administration du rémifentanil chez la rate en fin de gestation ou durant l'allaitement n'a pas provoqué d'effets significatifs sur la survie, le développement ou la reproduction de la génération F1 (1ère génération).
- Génotoxicité : Le rémifentanil n'entraîne pas de réponse positive dans une série de tests de génotoxicité in vitro et in vivo, à l'exception du test in vitro sur le lymphome TK de la souris qui s'est révélé positif avec activation métabolique. Les résultats du test sur le lymphome TK de la souris n'ayant pas été confirmés par les autres tests réalisés In vitro et in vivo, le traitement par le rémifentanil n'est pas considéré comme présentant un risque génotoxique pour le patient.
- Carcinogénicité : Aucune étude de carcinogénicité à long terme n'a été réalisée.
